Son constituyentes
químicos fundamentales e imprescindibles en la materia viva porque:
a)son los "instrumentos
moleculares" mediante los cuales se expresa la información genética; es decir, las
proteinas ejecutan las órdenes dictadas por los ácidos nucléicos.
b)son sustancias
"plásticas" para los seres vivos, es decir, materiales de construcción y
reparación de sus propias estructuras celulares. Sólo excepcionalmente sirven como
fuente de energía.
c)muchas tienen "actividad
biológica" (transporte, regulación, defensa, reserva, etc...). Esta característica
diferencia a las proteinas de otros principios inmediatos como glúcidos y lípidos que se
encuentran en las células como simples sustancias inertes.
| Funciones de las proteínas |
Las proteinas determinan la forma y la estructura de las células y dirigen casi todos los procesos vitales. Las funciones de las proteinas son específicas de cada una de ellas y permiten a las células mantener su integridad, defenderse de agentes externos, reparar daños, controlar y regular funciones, etc...Todas las proteinas realizan su función de la misma manera: por unión selectiva a moléculas. Las proteinas estructurales se agregan a otras moléculas de la misma proteina para originar una estructura mayor. Sin embargo,otras proteinas se unen a moléculas distintas: los anticuerpos a los antígenos específicos, la hemoglobina al oxígeno, las enzimas a sus sustratos, los reguladores de la expresión génica al ADN, las hormonas a sus receptores específicos, etc...
A continuación se exponen algunos ejemplos de proteinas y las funciones que desempeñan:
Función ESTRUCTURAL
-Algunas proteinas constituyen estructuras celulares:
-Otras proteinas confieren elasticidad y resistencia a órganos y tejidos:
-Las arañas y los gusanos de seda segregan fibroina para fabricar las telas de araña y los capullos de seda, respectivamente.
Función ENZIMATICA
-Las proteinas con función enzimática son las más numerosas y especializadas. Actúan como biocatalizadores de las reacciones químicas del metabolismo celular.
Función HORMONAL
-Algunas hormonas son de naturaleza protéica, como la insulina y el glucagón (que regulan los niveles de glucosa en sangre) o las hormonas segregadas por la hipófisis como la del crecimiento o la adrenocorticotrópica (que regula la síntesis de corticosteroides) o la calcitonina (que regula el metabolismo del calcio).
Función REGULADORA
-Algunas proteinas regulan la expresión de ciertos genes y otras regulan la división celular (como la ciclina).
Función HOMEOSTATICA
-Algunas mantienen el equilibrio osmótico y actúan junto con otros sistemas amortiguadores para mantener constante el pH del medio interno.
Función DEFENSIVA
Función de TRANSPORTE
Función CONTRACTIL
Función DE RESERVA
| |||||||||||||||
El pH es la escala que se utiliza para conocer la acidez ó alcalinidad de un elemento.
pH significa “potencial de Hidrógeno”.
La escala pH va desde 0 a 14. Un pH de 7 significa que existe equilibrio entre acidez y alcalinidad y es considerado neutro. Si este índice está por encima de 7,8 (excesivamente alcalino) ó por debajo de 7 (ácido) existe riesgo para la salud. El sistema que regula el pH en nuestro organismo intenta mantener el pH en 7,4 (ligeramente alcalino) que es el valor ideal.
Para que las células de nuestro cuerpo funcionen de forma correcta y adecuada su pH debe de ser ligeramente alcalino. En una persona sana el pH de la sangre se encuentra entre 7,40 y 7,45.
El torrente sanguíneo tiene que nutrir y oxigenar todos nuestros tejidos y órganos, pero además otra de sus funciones es recoger todos los deshechos o residuos tóxicos que el propio metabolismo celular origina y después pasar por diferentes órganos que depueren estos residuos (higado, riñones y pulmones).
Linus Pauling (químico ganador de dos premios Nobel) afirma que mantener el cuerpo con un pH alcalino es la clave de mantener una buena salud.
10 EJEMPLOS DE PH EN UESTRO CUERPO
algunos ejemplos.
Saliva - 6 a 7 de pH
Liquido Amniótico. 7 - 7.5 pH
Semen 7.2 - 8 pH
Lágrimas 7.5 pH
Orina 8.0 pH
Sangre 7.35 a 7.45 pH
Jugo Gástrico 1.5 pH
Saliva (pacientes con cáncer) 4,5 a 5,7
Sudor humano 5.5
Vomito 3,8 pH
ácido gástrico: 1.5
heces: 6 - 7
sudor: 6 - 8
cerumen: 6.1
semen: 7.5
fuido vaginal: 4.5 - 5
bilis: 7 - 7.
PORTAFOLIO DE BIOQUIMICA
Portafolio bioquimica carla from Carlita Atiencia
LA ACIDEZ Y LA BASICIDAD
 l comportamiento químico de los ácidos
puede resumirse en las
siguientes propiedades:
l comportamiento químico de los ácidos
puede resumirse en las
siguientes propiedades:
TRABAJO DE LABORATIO
video de las proteinas a los niños
LA ACIDEZ Y LA BASICIDAD
La
acidez y la basicidad constituyen el conjunto de propiedades
características de dos importantes grupos de sustancias químicas: los
ácidos y las bases. Las ideas actuales sobre tales conceptos químicos
consideran los ácidos como dadores de protones y las bases como
aceptoras. Los procesos en los que interviene un ácido interviene
también su base conjugada, que es la sustancia que recibe el protón
cedido por el ácido. Tales procesos se denominan reacciones ácido-base.
La
acidez y la basicidad son dos formas contrapuestas de comportamiento de
las sustancias químicas cuyo estudio atrajo siempre la atención de los
químicos. En los albores mismos de la ciencia química, Boyle y Lavoisier
estudiaron sistemáticamente el comportamiento de las sustancias
agrupadas bajo los términos de ácido y álcali (base).
Pero junto
con los estudios descriptivos de sus propiedades, el avance de los
conocimientos sobre la estructura del átomo y sobre la naturaleza íntima
de los procesos químicos aportó nuevas ideas sobre los conceptos de
ácido y de base.
En la actualidad, el resultado final de la evolución de esos dos conceptos científicos constituye un importante capítulo de la química general que
resulta imprescindible para entender la multitud de procesos químicos
que, ya sea en la materia viva, ya sea en la materia inerte, se engloban
bajo el nombre de reacciones ácido-base.
EL COMPORTAMIENTO QUÍMICO DE ...
El
estudio de los procesos químicos en los que intervienen ácidos y bases
ocupa un lugar destacado en la historia de la química. Antes de que se
conociera el comportamiento a nivel molecular de este tipo de
sustancias, se reconocían por sus propiedades características. Esta idea
de definir el concepto de ácido y de base indicando cómo ha de
comportarse químicamente una sustancia para que pueda considerarse como
miembro de una u otra familia de compuestos fue introducida por Boyle en
1663. Posteriormente un conocimiento más preciso de las fórmulas
químicas llevó a algunos investigadores, como Justus von Liebig
(1803-1873), a definir los ácidos por su composición molecular; sin
embargo, la vieja idea de Boyle, aunque transformada con las sucesivas
definiciones de ácidos y bases, sigue aún en pie.
Propiedades químicas de los ácidos
El comportamiento químico de los ácidos se resume en las siguientes propiedades:
· Poseen un sabor agrio. La palabra ácido procede, precisamente, del latín (acidus = agrio)
y recuerda el viejo procedimiento de los químicos antiguos de probarlo
todo, que fue el origen de un buen número de muertes prematuras, por
envenenamiento, dentro de la profesión.
· Colorean de rojo el papel de tornasol. El
tornasol es un colorante de color violeta en disolución acuosa (tintura
de tornasol) que puede cambiar de color según el grado de acidez de la
disolución. Impregnado en papel sirve entonces para indicar el carácter
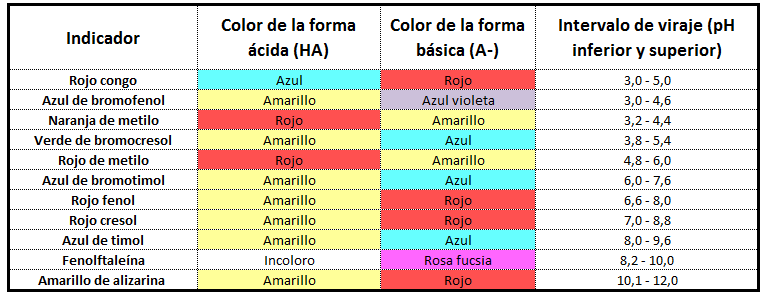
ácido de una disolución. Es, pues, un indicador.
· Sus disoluciones conducen la electricidad. La calidad
de una disolución ácida como conductor depende no sólo de la
concentración de ácido, sino también de la naturaleza de éste, de modo
que, a igualdad de concentración, la comparación de las conductividades
de diferentes ácidos permite establecer una escala de acidez entre
ellos.
· Desprenden gas hidrógeno cuando reaccionan en disolución con cinc o con algunos otros metales.
Propiedades químicas de las bases
Las bases, también llamadas álcalis, fueron
caracterizadas, en un principio, por oposición a los ácidos. Eran
sustancias que intervenían en aquellas reacciones en las que se
conseguía neutralizar la acción de los ácidos. Cuando una base se añade a
una disolución ácida elimina o reduce sus propiedades características.
Otras propiedades observables de las bases son las siguientes:
· Tienen un sabor amargo característico.
· Al igual que los ácidos, en disolución acuosa conducen la electricidad.
· Colorean de azul el papel de tornasol.
· Reaccionan con los ácidos para formar una sal más agua.
Propiedades químicas de los ácidos
 l comportamiento químico de los ácidos
puede resumirse en las
siguientes propiedades:
l comportamiento químico de los ácidos
puede resumirse en las
siguientes propiedades:
Poseen un sabor agrio
La palabra ácido procede, precisamente, del latín (acidus =
agrio) y recuerda el viejo procedimiento de los químicos antiguos de
probarlo todo, que fue el origen de un buen número de muertes prematuras, por
envenenamiento, dentro de la profesión.
Colorean de rojo el papel de tornasol
El tornasol es un colorante de color violeta en disolución
acuosa (tintura de tornasol) que puede cambiar de color según el grado de acidez
de la disolución. Impregnado en papel sirve entonces para indicar el carácter
ácido de una disolución. Es, pues, un indicador.
Sus disoluciones conducen la
electricidad
La calidad de una disolución ácida como conductor depende
no sólo de la concentración de ácido, sino también de la naturaleza de éste, de
modo que, a igualdad de concentración, la comparación de las conductividades de
diferentes ácidos permite establecer una escala de acidez entre ellos.
Desprenden gas hidrógeno
Se produce desprendimiento de gas hidrógeno cuando reaccionan en disolución con
cinc o con algunos otros metales.
El papel de tornasol es un indicador de pH que se colorea de rojo sumergido en un ácido y de azul cuando lo hace una base. Cuanto más fuerte sea el ácido o la base, más intenso será el color del indicador.
Propiedades químicas de las bases
Las bases, también llamadas álcalis, fueron
caracterizadas, en un principio, por oposición a los ácidos. Eran sustancias que
intervenían en aquellas reacciones en las que se conseguía neutralizar la acción
de los ácidos. Cuando una base se añade a una disolución ácida elimina o reduce
sus propiedades características.Otras propiedades observables de las bases son las siguientes:-
Tienen un sabor amargo característico.
- Al igual que los ácidos, en disolución acuosa conducen la electricidad.
-
Colorean de azul el papel de tornasol.
-
Reaccionan con los ácidos para formar una sal más agua.
TRABAJO DE LABORATIO
video de las proteinas a los niños












No hay comentarios:
Publicar un comentario